貯蔵病
定義
貯蔵病という用語は、代謝の障害されたプロセスのために特定の物質が臓器または細胞に沈着する多くの疾患を包含する。
物質と臓器に応じて、貯蔵病はその重症度と形態が大きく異なります。
いくつかの貯蔵病は出生時にすでに現れており、即時の治療を必要としますが、他の貯蔵病は人生の過程でのみ現れます。

どんな貯蔵病がありますか?
-
鉄蓄積症-ヘモクロマトーシス
-
銅貯蔵病-ウィルソン病
-
タンパク質蓄積症
-
グリコーゲン蓄積症
-
リソソーム蓄積症
-
コレステロールエステル蓄積症
-
心筋蓄積症
-
中性脂肪蓄積症
鉄貯蔵病
専門家の間ではヘモクロマトーシスとして知られている鉄蓄積症は、体内や特定の臓器への鉄の沈着が増加している代謝性疾患です。
ほとんどの場合、鉄蓄積症は、消化管からの鉄の過剰吸収につながる遺伝性の欠陥です。
吸収された過剰な鉄は、吸収されるとすぐに排泄されないため、さまざまな臓器に沈着します。
影響を受ける臓器と鉄の量に応じて、ヘモクロマトーシスのさまざまな症状と愁訴が発生する可能性があります。
まれなケースとして、鉄貯蔵病は、他の基礎疾患の結果として、または二次ヘモクロマトーシスとして知られている頻繁な輸血の結果としても発生します。
通常は鉄の貯蔵庫として機能しない臓器に貯蔵されている追加の鉄は、改造プロセスにつながります。
これらのリモデリングプロセス中に、瘢痕組織の形態が作成されます。これにより、健康な臓器組織が置き換わり、臓器の機能が低下します。
多くの場合、これは主に肝臓(ほとんどの場合)や膵臓などの腹部のホルモン産生器官に影響を与えます。
心臓、皮膚、下垂体などの臓器も、最も頻繁に損傷を受ける臓器の一部です。
病気の経過は通常潜行性であり、したがって、病気の進行した段階でのみ気づかれることがよくあります。
症状は、損傷の程度と影響を受ける臓器によって異なります。
疲労や疲労感などの一般的な症状は、最初は典型的です。
病気の過程では、通常、指の関節、特に人差し指と中指に関節の痛みがあり、皮膚の茶色が目立つようになります。
血液検査と個々の臓器の特別な生検の助けを借りて、どの臓器がどの程度影響を受けているかを正確に診断できます。
最も一般的で典型的な臓器症状は、主に肝癌の発症の高リスク因子である肝硬変を伴う肝臓、および糖尿病の発症を伴う膵臓です。
鉄貯蔵病を治療するための選択肢は、過剰な鉄の定期的な排泄に限られています。
原因となる治療法はまだ知られていない。
何よりもまず、低鉄食を推奨します。また、これは腸内の鉄の吸収を減らすため、定期的に紅茶を摂取することをお勧めします。
低鉄食にもかかわらず、鉄価が上昇している場合は、流血が最適な方法です。
ここでは、患者から500 mlの血液が採取され、血液細胞に結合した鉄が失われます。
血中鉄濃度が目標値に達した後は、2〜3か月ごとに検査室で綿密に検査することが推奨されます。
月経出血は十分な鉄の損失につながるため、この介入は出産適齢期の女性ではしばしば省略できます。
流血の代替として、鉄結合薬が利用可能ですが、これらは、例えば貧血-貧血-または他の基礎疾患のために、流血が実行不可能な場合にのみ使用されます。
早期診断と一貫した治療により、鉄貯蔵病に罹患している人は通常の平均余命があります。
銅蓄積症
銅蓄積症、いわゆるウィルソン病は、銅の排泄障害に基づく代謝性疾患です。
これの理由は、胆汁中の排泄のために銅を準備するタンパク質の遺伝的遺伝的欠陥です。
ここに欠陥があると、銅は十分な量で排出されなくなります。
それは血流に蓄積し、その結果、さまざまな臓器に沈着します。
通常、銅は主に肝臓、角膜、赤血球、脳に沈着します。
特に、肝臓と脳の関与は、典型的な症状を組み合わせて引き起こし、銅蓄積症の疑われる診断につながります。
最初の症状は5歳から10歳の間に現れることが多く、たとえば肝炎として知られている肝臓の炎症や、眠気や手の震えなどの肝機能低下による神経学的制限の形で現れます。
10歳から、通常、細かい手の振戦、認知症、嚥下障害、言語障害、歩行障害などの神経学的な不快感が現れます。
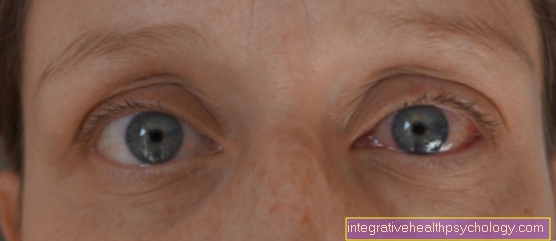
さらに、銅の堆積物が目に見えるようになります。
こちらが角膜の緑褐色の輪です。
銅蓄積症の診断は、血液および尿検査、おそらく肝臓の生検およびさまざまな画像検査の助けを借りて確認できます。
銅蓄積症の診断が確定した一次療法は、低銅食と銅排泄に役立つ薬剤、いわゆるキレート剤(D-ペニシラミンなど)の組み合わせで構成されます。
治療が早期かつ一貫して開始されれば、疾患の予後は良好です。
唯一重要なことは、銅の沈着による臓器の損傷が発生する前に、早期診断を行うことです。
以下が適用されます:45歳以前の不明確な運動障害と組み合わせた、感染に起因しないすべての不明確な肝疾患は、銅蓄積症に関して明確にすべきです。
記事も読む:遺伝子検査
タンパク質蓄積症
世界保健機関によると、いわゆるタンパク質蓄積症は、認められた臨床像ではありません。
むしろ、博士博士がLothar Wendtが開発および公開されました。
ウェント教授の研究では、伝統医学の見方と「なぜ」の問題を対比させて、私たちの社会の一般的な病気を説明する別のアプローチを追求しました。
このアプローチの典型的な例は、一般的な病気の糖尿病で説明できます。
2型糖尿病では、血糖値が非常に高いです。
これらの増加した血糖値は、深刻な合併症を伴う全身の損傷につながります。
したがって、従来の医学的アプローチは、さらなる損傷を防ぐために一貫して血糖値を下げることです。
一方、ウェント教授は、これらの増加した血糖値が発生する理由と、その理由が代償であるかどうかを、彼の作業概念で尋ねています。
ここで彼は、血管壁にタンパク質が沈着すると血管が肥厚するという理論を提唱しています。
ウェント教授は、血糖値の増加は、抵抗の増加と拡散経路の延長にもかかわらず、十分な量の糖を細胞内に輸送するための、肥厚した血管壁への反応であると説明しています。
ウェントによれば、病気の原因となるのは糖ではなく、タンパク質であり、最終的には糖尿病という用語は誤解を招くものです。
彼の概念によれば、原因となるタンパク質貯蔵病の結果としての血糖値の上昇という用語はより適切でしょう。
しかし、現時点では、この説明的アプローチと疾患の概念を裏付けるエビデンスに基づく研究が不足しています。
変形性関節症の治療においてのみ、標的タンパク質分解療法により変形性関節症を緩和または排除したと報告しているいくつかの自助グループにすでに影響を受けている人々がいます。
ただし、これらは参照グループなしの個々の経験値であり、治療が疾患の非常に早い段階で開始された場合にのみ成功したことに注意する必要があります。
さまざまな学部の主要な教授は、現在の研究状況を考慮に入れると、ウェント教授によるタンパク質蓄積症の概念の正確さを示す証拠はないと考えています。
グリコーゲン蓄積症
グリコーゲン貯蔵病では、遺伝性の遺伝的欠陥により、体内にグリコーゲンが過剰に沈着します。
グリコーゲンは、口語的に肝臓澱粉としても知られています。
これは長くて多分岐のグルコース分子であり、特に肝臓に保存され、エネルギー担体糖の供給源として機能します。
グリコーゲン蓄積症には、合計9つの異なる形態があり、それぞれが異なる遺伝的欠陥に基づいており、異なる臓器にグリコーゲンが沈着します。
最も一般的な形態には、グリコーゲン蓄積症I型フォンギエルケ病、グリコーゲン蓄積症II型、ポンペ病、およびグリコーゲン蓄積症V型、マッカードル病が含まれます。
さまざまな形態は、症状と発症の両方が異なります。
I型グリコーゲン蓄積症は、通常、肝臓の肥大と腹部の膨張によって顕著になります。さらに、発作や出血する傾向があります。
II型グリコーゲン蓄積症では、全身の筋肉の消耗と特大の舌が特に目立ちます。
V型グリコーゲン蓄積症においても、全身の筋肉の消耗が起こりますが、運動後の筋肉痛やけいれんと組み合わされます。
グリコーゲン蓄積症の治療は、疾患の種類とその重症度によって異なります。
リソソーム蓄積症
リソソーム蓄積症という用語は、リソソームの遺伝的欠陥に基づく疾患の大きなグループを包含する。
リソソームは、人体の細胞のグループであり、胃や細胞のゴミ箱のように機能します。
細胞のすべての過剰な細胞成分と老廃物は、リソソームで分解されます。
リソソームに欠陥がある場合、これらの細胞老廃物が蓄積し、それが細胞内と他の臓器の両方に堆積します。
現在、45の疾患がリソソーム蓄積症のグループに割り当てられています。
ほとんどの病気は非常にまれな貯蔵病の変種です。
リソソーム蓄積症の最も一般的な形態は、ゴーシェ病とファブリー病です。
トピックの詳細を読む: ファブリー病
ゴーシェ病では、破壊された分解プロセスにより、細胞や他の臓器に脂肪が蓄積します。
全身に影響を与える可能性があるため、症状は大きく異なります。
肝臓と脾臓の肥大、造血系の障害、発作が典型的です。
この疾患は、摂食障害のために乳児期にしばしば目立ちます。
一方、ファブリー病はゴーシェ病よりもはるかにまれであり、その遺伝により主に男児に発症します。
ファブリー病の症状には、最初、指の灼熱発作、胃腸の不調、角膜混濁があります。
その後、心臓は心不全や脳卒中に感染する可能性があります。
トピックの詳細については、こちらをご覧ください。 ゴーシェ病。
コレステロールエステル蓄積症
コレステロールエステル蓄積症は、まれな遺伝性代謝性疾患であるリソソーム蓄積症のグループに属しています。
コレステロールエステル病は、リソソームの酸性リパーゼの欠陥に基づいており、通常、コレステロールエステルやトリアシルグリセリドなどの脂肪を分解します。
これらの脂肪の分解が減少すると、細胞内、したがって体の循環内にも脂肪が蓄積されます。
この病気は長期間不快感を引き起こさず、肝臓の反応性肥大のみが右上腹部の圧迫感、吐き気、または膨満感を引き起こします。
血液検査では、コレステロールと脂質の血中濃度の上昇と、良好な脂肪(HDL)の血中濃度の低下が示されています。
上腹部の超音波検査で脂肪肝が現れることがあります。
コレステロールエステル蓄積症の治療は、コレスチラミンまたはエゼチミブでコレステロールの取り込みを阻害し、さらにシンバスタチンなどのスタチンで血中脂質値を低下させることにより、薬物で行われます。
心筋蓄積症
心筋蓄積症では、分解産物が心臓壁に沈着し、心臓の機能とポンプ機能を著しく制限する可能性があります。
2つの異なる貯蔵病が心臓壁にこれらの沈着を引き起こす可能性があります。まれな遺伝性のリソソーム貯蔵病ファブリー病といわゆるアミロイドーシスです。
ファブリー病では、遺伝性の遺伝的欠陥により代謝産物の分解が減少し、その結果、とりわけ心臓壁に蓄積し、深刻な損傷を引き起こす可能性があります。
一方、アミロイドーシスは遺伝性である可能性もあり、人生の中で獲得する可能性もあります。
この臨床像でも、他の臓器に加えて、主に心臓に蓄積し、ここで心臓の機能を厳しく制限する、異常に変化した代謝産物の沈着物があります。
心筋蓄積症は、最初は脱力感や疲労感などの一般的な症状によって顕著になります。
時間の経過とともに、運動後やある時点で安静時の呼吸不足が増加しています。
肺、腹部、脚、心膜の水分は、疾患が進行するにつれて典型的な副作用となります。
心筋蓄積症を明確に診断するには、画像検査と心筋生検が必要です。
その後の治療は、それを引き起こした基礎疾患に基づいて行われます。
中性脂肪蓄積症
中性脂肪貯蔵疾患は、脂肪の分解と貯蔵、いわゆるトリグリセリドに欠陥がある非常にまれな疾患です。
今日まで、中性脂肪蓄積疾患の50例のみが世界中で報告されています。
ほとんどの貯蔵病と同様に、遺伝的欠陥の原因は中性脂肪貯蔵病にも遺伝性です。
この疾患は、発達障害のために幼児期にしばしば見られます。
罹患した人の大多数は、関連する肝機能障害を伴う肥大した肝臓、ならびに眼の問題および難聴を発症します。
筋肉の消耗と歩行障害は、高齢になると起こります。