ヘモクロマトーシス
同義語
原発性シデローシス、ヘモジデローシス、シデロフィリア、鉄蓄積症
英語: ヘマトクロマトーシス
前書き
ヘモクロマトーシスは、上部小腸で鉄の吸収が増加する疾患です。
この鉄の取り込みの増加は、体内の総鉄が2〜6 gから最大80 gの値に増加することを意味します。
この鉄過剰は、心臓、肝臓、脾臓、膵臓、甲状腺、いわゆる下垂体などの多くの異なる器官に鉄沈着物が形成され、長期間にわたって器官の機能を損なう結果をもたらします。

疫学/頻度分布
ヘモクロマトーシスはまれな病気です。
北ヨーロッパの人口の約0.3-0.5%がこの病気の影響を受けています。
受け継がれた人たち(ホモ接合)遺伝的欠陥がある。北欧の人口の約10%がHFE遺伝子欠損症のために混血です。現在、ドイツでは約20万人がヘモクロマトーシスを患っていると推定されています。
また、HFE遺伝子欠損症の遺伝した人が病気を発症しないこともあります。これは、病気の浸透度が異なるためです。
女性は毎月5〜10倍の頻度で病気になります。これは、女性が毎月血を失い、したがって鉄も失うためです。
患者の過半数は、生後40年から60年の間にヘモクロマトーシスを発症します。
原因

内科の多くの病気と同様に、ヘモクロマトーシスは一次型と二次型に分けることができます:
- この意味で、一次とはヘモクロマトーシスが基礎疾患であることを意味し、二次ヘモクロマトーシスでは別の原因となる疾患が鉄過剰の原因となっています。
原発性ヘモクロマトーシスは、遺伝性疾患のグループに属しています。この場合、誤った情報がゲノムに含まれており、正常な鉄のバランスを混乱させます。
この遺伝性疾患が遺伝的にどのように振る舞うかを知ることも重要であるため、ヘモクロマトーシスは、 常染色体劣性 遺伝性疾患。
これは、同じ遺伝的欠陥を持つ2人の子供がいる場合にのみ、病気が発症することを意味します。
劣性遺伝性疾患とは対照的に、優性遺伝性疾患があります。
ここで、片方の親が遺伝子について誤った情報を持っている場合はそれで十分です。
先に述べたように、遺伝性疾患では特定の遺伝子に欠陥があり、それが発症する可能性があります。
ヘモクロマトーシス患者の80%では、いわゆるHFE遺伝子に変異があります。
HFE遺伝子には、専門用語で遺伝性ヘモクロマトーシスタンパク質と呼ばれるタンパク質の情報が含まれています。
このタンパク質の機能は、別の物質、つまりヘプシジンの生産を開始することです。ヘプシジンは他のタンパク質と一緒になって、腸からの氷の吸収を防ぎます。 HFEタンパク質が乱されると、ヘプシジンは生成されず、腸はチェックされていない鉄を吸収できます。
体は、鉄の排泄の可能性がさらに与えられていないため、腸からの鉄の除去に依存しています。
続発性ヘモクロマトーシスは、別の既存の基礎疾患から生じます:
- この獲得された鉄過剰は、例えば、単に食物による過剰な鉄摂取の結果である可能性があります。
これは、スピリッツが鉄の器で蒸留される南サハラ地域でより頻繁に発生します。
- 他のケースでは、例えば、貧血との関連で通常使用される輸血は、二次性ヘモクロマトーシスを引き起こす可能性があります。
- 溶血(赤血球の破壊)は、赤血球から放出された鉄が体内に蓄積するため、鉄の過負荷を引き起こす可能性もあります。
症状
ヘモクロマトーシスの症状は、さまざまな臓器での鉄沈着の増加に起因し、細胞の損傷につながります。
とりわけ、預金があります:
- 肝臓
- 膵臓
- 脳下垂体
- 心と
- 関節
病気の最初は、影響を受けた人は通常、症状や変化に気づきません。症状は数年後に現れます。
- 男性の場合、初期症状は通常30歳から50歳の間に現れます。
- 一方、女性の場合、最初の症状は閉経後に現れます。閉経前の過剰な鉄は月経によって自然に排泄され、妊娠と授乳のために鉄の必要量が増加する可能性があるためです。
典型的なのは、次のような不特定の初期症状です。
- 倦怠感
- 憂鬱な気分
- 上腹部の痛みと
- 関節の不快感
関節の愁訴は主に中手関節の人差し指と中指に影響します。しかし、膝関節などのより大きな関節もしばしば影響を受けます。治療中の関節の不調はほとんど改善されず、生活の質が大幅に低下する可能性があります。
とりわけ、肝臓での鉄沈着の増加があるため、これは肝臓の結合組織の増加につながり、これは技術的に肝線維症として知られています。
肝臓の酵素が増加し、肝臓が肥大します。その後、肝臓も瘢痕を伴って再形成される場合、それは肝硬変と呼ばれます。さらなる段階では、肝硬変は極端な場合には小細胞肝癌に変わります。
肝臓の機能は結合組織のリモデリングによって制限されています。
さらに、必ずしもすべての患者で発生する必要のない他の典型的な症状があるかもしれません。これには、とりわけ、日光にさらされた皮膚領域の皮膚色素沈着の増加が含まれます。
さらに進むと、皮膚は青銅色になります。これは、メラニン生成の増加(=皮膚色素)メラニンはとりわけ鉄から形成されるためです。
排尿の増加や喉の渇きの増加などの砂糖障害の症状も発生する可能性があります。鉄沈着によって膵臓が損傷するという事実は、実際には進行した段階で糖尿病の発症につながります(砂糖病).
これにより、脱毛が増加し、髪の灰色が早まります。
また、インポテンスにつながり、女性では月経出血が変化したり、完全に止まったりすることもあります。
下垂体への沈着はしばしば男性のテストステロン欠乏症につながり、その結果性欲が低下します(欲望)そして早期閉経のための女性。
さらに、心筋に鉄が沈着すると、心不全を引き起こし、息切れや不整脈を引き起こす可能性があります。
さらに、骨粗しょう症が発症する可能性があります。
肝臓癌や膵臓癌などの癌も、臓器の鉄沈着物によって引き起こされる毒性のある細胞損傷の一部として発生する可能性があります。
トピックの詳細を読む:
- ヘモクロマトーシスの症状
皮膚の症状は何ですか?
通常、ヘモクロマトーシスの患者さんは、皮膚の褐色がかった青銅色の色素沈着(変色)を持っています。
このより暗い肌の色は、主に日光にさらされている肌の領域に見られます:
- 腕と手の伸筋側、
- 首、
- 面、
- 下肢。
さらに、乳首、脇の下、手のひら、生殖器領域も暗い色素沈着の影響を受けます。
ヘモクロマトーシス患者の75%は脇の下に色素沈着があり、脇の下の毛もありません。
他のすべての暗い肌の領域も、ヘモクロマトーシスでは無毛です。高色素沈着は、ヘモクロマトーシスでしばしば発生する色素メラニンの過剰産生が原因です。
目の症状は何ですか?
ヘモクロマトーシスでは眼の症状は(これまでのところ)知られていません。
ヘモクロマトーシスと白内障(白内障)に関する個々の症例報告しかありません。
ヘモクロマトーシスは、カイザーフライシャー角膜輪として知られている、虹彩の縁にある輪に銅が沈着する銅蓄積症であるウィルソン病と混同しないでください。
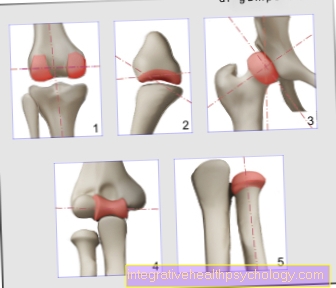
関節の症状は何ですか?
ヘモクロマトーシス患者の約50%で、この疾患はいわゆる関節症として現れます。 」
関節症は、関節疾患にすぎません。ヘモクロマトーシスの関節症は痛みを伴い、主に人差し指と中指の中足指節関節に発生します。
中央と手首の関節も頻繁に影響を受けます。
股関節および膝関節症の早期発症は、ヘモクロマトーシス患者でも知られています。
残念ながら、流血による治療は、初期のヘモクロマトーシスによって引き起こされる関節疾患の発生を防ぐことができるだけであり、すでに存在している関節の損傷は治療によって元に戻すことはできません。
変形性関節症を認識する方法を知りたいですか?これを行うには、私たちの記事を読んでください:
- 変形性関節症の症状
診断
症候的にヘモクロマトーシスが疑われる場合は、最初の調査のために採血し、トランスフェリン飽和が60%を超えているかどうか、および血清フェリチンが300ng / mlを超えているかどうかを確認します。
トランスフェリンは血中の鉄輸送体として機能し、フェリチンは体内の鉄貯蔵の機能を引き継ぎます。
これらのトピックにも興味があるかもしれません: フェリチンとフェリチンのレベルが高すぎる
両方の値が上昇している場合、人口の約0.5%がホモ接合型キャリアであるため、遺伝子検査が実施されます(遺伝子の両方のコピー)ヘモクロマトーシスの状態。
北ヨーロッパの8〜10番目ごとに遺伝子のシステムがあり、したがって、このシステムを継承できます。
遺伝子検査が陽性の場合、通常、流血療法が行われます。遺伝子検査が陰性の場合は、肝臓のMRI画像を作成して、肝臓の鉄沈着を検出します。
これが陽性であれば、流血療法も行われます。
追加の臓器機能検査も実施できます。
最終的にヘモクロマトーシスと診断された場合は、兄弟などの近親者でも遺伝子検査を実施して、できるだけ早く疾患を発見することをお勧めします。
遺伝子検査はどのように機能しますか?
遺伝子検査では、患者が特定の同意を得た後、最初に採血します。
少なくとも2mlの血液が入った、いわゆるEDTA血液チューブが必要です。
医師なら誰でもこの血液チューブを取り外して、検査室に送って遺伝子検査を行うことができます。
ヘモクロマトーシス患者の血縁者の検査は、遺伝子診察の後にのみ許可されます。
血液は、PCR(ポリメラーゼ連鎖反応)および/またはRFLP(制限断片長多型、「遺伝的フィンガープリント」)を使用して実験室で検査されます。
これらのテスト手順では、影響を受けるHFE遺伝子の遺伝子変異を探します。
患者の90%が両方の遺伝子領域にC282Y変異を持っています。
約2週間の処理後に結果が期待できます。
遺伝子検査の費用はいくらですか?
ヘモクロマトーシスの疑いで遺伝子検査が行われた場合、健康保険会社が費用を負担します。
患者さんの要望に応じた遺伝子検査は、症状はありませんが、人間の遺伝学者と相談した後にのみ実施でき、患者本人が負担する必要があります。このためのコストは異なります。
かかりつけの医師または胃腸科医が費用を負担するためにサンプルを送付する検査室に依頼するのが最善です。
血中値にはどのような変化がありますか?
ヘモクロマトーシスの血液値をよりよく理解するために、この疾患で変化する重要な検査値の説明を次に示します:
-
血清鉄:
この値は、血清中の鉄の濃度を表し、時間帯によって強い変動の影響を受けます。そのため、フェリチンは患者の鉄のバランスについてより良い説明を可能にします。
トランスフェリン飽和を計算するには、血清鉄が必要です(以下を参照)。 -
フェリチン:
このタンパク質は鉄を生物学的形態で貯蔵するため、フェリチンは「貯蔵鉄」としても知られています。
血中で測定可能なフェリチンレベルは、体の鉄貯蔵に関連しています。
以下が適用されます:鉄の高蓄積→高フェリチン、低鉄の蓄積→低フェリチン。
通常の値は、年齢と性別によって異なります。
ヘモクロマトーシスでは、体の鉄貯蔵庫がいっぱいであるか、過剰に満たされているため、フェリチンレベルが上昇します。ヘモクロマトーシスの値は300 µg / lを超え、6,000 µg / lに増加する可能性があります。
フェリチンは体内のさまざまな炎症過程でも増加するため、「ヘモクロマトーシス」の診断は、フェリチン値が高すぎる場合にのみ行うことができません。
フェリチン値の上昇についての詳細は、以下をご覧ください。 フェリチンレベルが上昇
-
トランスフェリン:
トランスフェリンは鉄の輸送タンパク質です。それは、腸、鉄貯蔵所、およびヘモグロビン、赤い血液色素の生産に必要な血液生産の場所の間の鉄の輸送を保証します。
トランスフェリンの通常の値は200-400 mg / dlです。
ただし、トランスフェリンの飽和は、トランスフェリンのレベルよりも意味があります。 -
トランスフェリン飽和:
この値は、血清鉄とトランスフェリンから計算され、現在鉄で占められている血液中のトランスフェリンの割合を示します(つまり、現在、体内で鉄をAからBに輸送しています)。
ヘモクロマトーシスでは、この値が増加します:
女性は45%以上、男性は55%以上の価値があります。その理由は、鉄の吸収が増加するため、この鉄を体内に分布させる必要性が高まるためです。
通常のトランスフェリン飽和は、ヘモクロマトーシスを予防する可能性が高いです。
治療
ヘモクロマトーシスの治療は、体の鉄の減少で構成されています。
これは、ほとんどの場合、比較的古い流血療法によって可能になります。
瀉血療法は2つのフェーズで構成されます。
- 最初の治療は、フェリチンレベルを50 g / l未満に下げるために、毎回500 mlの血液を流血させることから始まります。
- 長期治療は低フェリチンレベルを維持するのに役立ち、年間500 mlの約4〜12回の出血が含まれます。これは、ヘモクロマトーシスで体内の鉄過剰を防ぐためです。約200 mgの鉄が、1回の出血で体内から排出されます。
血液再生さえも確実にするために、これらの流血が定期的に行われることが重要です。
鉄分を多く含む食品は減らす必要があるため、食事療法もヘモクロマトーシスで重要な役割を果たします。
これらの食品には、例えば:
- ほうれん草、
- キャベツ、
- レンズ、
- 肉と
- 粒。
ビタミンCを含む飲料は、特に鉄分が豊富な食品を同時に食べた場合、鉄分の吸収を高めます。したがって、ビタミンCは食事の2時間後に摂取する必要があります。
アルコールはまた、胃腸管での鉄の吸収を増加させるため、回避する必要もあります。
プロトンポンプ阻害剤(胃酸の生成を阻害する)のクラスの薬剤は、鉄が腸で再吸収されるのを防ぎます。
他の臓器がすでに罹患している場合、もちろんそれらも治療的に治療しなければなりません。
ヘモクロマトーシスの特別なケースでは、例えば、心臓機能がひどく損なわれている場合、心臓は血液量の減少に対処できないため、鉄バインダーを使用する必要があります(流血によって引き起こされた)心拍数の増加を補うため。
肝臓がひどく損傷している場合(肝硬変)、臓器移植を検討する必要があります。
流血療法
ヘモクロマトーシスは、流血療法で治療されます。これは患者にとって非常にストレスになる可能性があります。過剰に満たされた鉄の店は、流血によって空にされます。
治療の開始時に、約500mlの血液が1〜2週間ごとに排出されます。
流血療法は、血清フェリチンが50 µg / l未満の値に達するまで継続されます。
進行したヘモクロマトーシスでは、これには1〜2年かかることがあります。
この後、いわゆるメンテナンスフェーズが続きます。このフェーズでは、フェリチンを50〜100 µg / lの値に維持するために、3か月ごとにのみ出血が必要です。
ヘモクロマトーシスはほとんどが遺伝性であり、原因を取り除くことはできないため、治療を一生続ける必要があります。
流血療法に加えて、薬物療法も可能ですが、流血療法の方が効果的で、副作用も少なくなります。
ヘモクロマトーシスにかかった場合、どうやって適切に食べるのですか?
血液療法の効果を無効にしないように、食事による鉄の蓄積を避けることが重要です。
したがって、動物の内臓など、鉄分が多い食品は避けてください。
それ以外の場合、実際には栄養面での制限はありません。
紅茶や牛乳を食事と一緒に少し飲むと、小腸での鉄の吸収が低下するため、ヘモクロマトーシスの人に役立ちます。
ビタミンCは食品からの鉄の吸収を促進するため、ビタミンCを含むフルーツジュースは、食事の前後約2時間は飲まないでください。
診断後、鉄の貯蔵がなくなるまでアルコールを避けることが重要です(約1〜1.5年間の流血療法後)。
さらに、肝細胞への損傷を制限するためにアルコールを避けることは理にかなっています。
ヘモクロマトーシスにかかった場合、アルコールは飲めますか?
ヘモクロマトーシスによって引き起こされる鉄過剰は肝臓に損傷を与え、患者の4分の3は肝硬変を引き起こし、肝臓に不可逆的な損傷を与え、瘢痕化と機能喪失を引き起こします。
定期的にアルコールを飲むと、これも肝細胞を損傷し、肝硬変を引き起こす可能性もあります。
ヘモクロマトーシス患者はいくつかの理由でアルコールを避けるべきです:
定期的なアルコール摂取は鉄の代謝を妨害し、(ヘモクロマトーシスがなくても)鉄の過負荷を引き起こす可能性があります。
その後、効果が加算されます。
定期的なアルコール消費は、ヘモクロマトーシス患者に追加の鉄過剰を引き起こします。ヘモクロマトーシスで肝臓への追加の損傷を防ぐために、この疾患の患者は定期的なアルコール摂取を控えるべきです。
診断後、定期的な流血によって鉄の店が空になるまでは、アルコールを完全に避ける必要があります。
定期的な流血の副作用は何ですか?
流血療法の典型的な副作用は
- 倦怠感、
- 疲労と
- めまい。
原因は、体が不足しているボリュームです。
流血後にこれらの症状が頻繁に発生する場合は、失われた水分を補うために点滴を行うことができます。
あるいは、採血は、より少ない血液を採取する必要があるいくつかのセッションに分けることができます。
予報
ヘモクロマトーシスの予後は、影響を受ける臓器への付随する損傷に最も依存します。
ほとんどの場合、肝臓は鉄貯蔵の増加によって損傷を受けます。これはしばしば肝硬変の画像につながります。
特にヘモクロマトーシスが長期間検出されないままである場合、肝硬変が発症します。
肝癌の発症における肝硬変の主な合併症は、それ自体が予後不良です。鉄の過負荷が持続するほど、臓器、特に肝臓が損傷する可能性が高くなります。
重大なヘモクロマトーシスの患者の約35%は、後で肝細胞癌を発症します。
ヘモクロマトーシスは平均寿命にどのように影響しますか?
肝硬変がまだ存在しない潜伏期にヘモクロマトーシスが発見され、流血療法で適切に治療される場合(治療目標は血清フェリチン<50 µg / l)、罹患した患者の平均余命はありません。
適切な治療は、鉄が肝臓に蓄積し、肝細胞に損傷を与えるのを防ぐことができます。
ただし、肝臓に不可逆的な損傷がすでに発生している場合にのみ疾患が診断されると、平均余命は大幅に短縮されます。肝硬変の重症度によっては、1年生存率が35〜100%になります。
ヘモクロマトーシスと肝硬変
肝臓はヘモクロマトーシスでひどく影響を受けます。
患者の90%は、疾患の結果として肝臓の肥大(肝腫大)を発症します。
多くの患者(症例の75%まで)では、肝硬変は時間の経過とともに発症します。
肝硬変は、瘢痕化したリモデリングと機能障害を伴う肝組織の不可逆的な疾患です。それがヘモクロマトーシス患者で発生すると、それは肝臓移植でのみ排除することができます。
肝硬変は肝がんのリスクを著しく高めます。
肝硬変についてもっと知りたいですか?これを行うには、次の記事を読みます。
- 肝硬変の治療
ヘモクロマトーシスおよび真性糖尿病
ヘモクロマトーシスにおける鉄の貯蔵は、肝臓だけでなく他の多くの臓器にも影響を与えます。とりわけ、ホルモンのインスリンを産生する膵臓が影響を受けます。
インスリンは糖代謝に不可欠です。
膵臓は鉄の貯蔵によって損傷を受けます。つまり、インスリンの生成が減少するか、完全に停止する可能性があります。
これが事実である場合、糖代謝を維持するためにインスリンを交換しなければならない糖尿病(「糖尿病」)の一種である、いわゆる「ブロンズ糖尿病」について話します。
糖尿病は、ヘモクロマトーシス患者の症例の最大70%で発生します。
この随伴性疾患の影響も受けているかどうかわかりませんか?これに関する私たちの記事を読んでください:
- どうすれば糖尿病を認識できますか?
ヘモクロマトーシスと多発神経障害
多発神経障害は、いくつかの神経(通常は脚や腕)が影響を受ける神経の損傷を表します。
これは、ヘモクロマトーシスの典型的かつよく研究された副作用の1つではありません。
少数の患者を対象としたこのテーマに関する研究はほんのわずかです。
ヘモクロマトーシスと多発性神経障害の関連を示唆する研究がありますが、HIV薬による治療中の多発性ニューロパシーの発症に対するヘモクロマトーシスの保護効果についても述べています。
しかし、確かなことは、進行したヘモクロマトーシスと真性糖尿病では、二次的疾患として糖尿病性多発神経障害が発生する可能性があるということです。
これについてもっと読む:
- 糖尿病性神経障害
ヘモクロマトーシスとくま
多くの小さな血管が供給に関与しているため、目の下の皮膚には血液が十分に供給されています。さらに、体のこの領域には皮下脂肪組織がほとんどなく、非常に細いため、これらの血管はここから簡単に輝くことができます。
鉄欠乏症があると、貧血によって血液中の酸素含有量が減少し、血液がより暗く見え、目の下の薄い皮膚を通して目の下に輪として現れます。
くまはヘモクロマトーシスの典型的な症状ではありませんが、大量の出血により鉄欠乏症が発生した場合、他の症状(疲労など)とともに発生する可能性があります。
歴史
ヘモクロマトーシスの出現に関する最初の兆候は、19世紀にアルマントルソー氏から出されました。
彼は、肝硬変、糖尿病、黒ずんだ皮膚の色素沈着からなる複雑な症状について説明しました。
20年後、ヘモクロマトーシスという用語が作り出されました。
1970年代、常染色体劣性遺伝様式が認められ、90年代にようやく原因遺伝子(HFE遺伝子)が発見されました。
科学者たちは、鉄がより多く貯蔵されていたため、この遺伝子の突然変異が栄養失調の時代に生存の利点を提供したと信じています。
概要
ヘモクロマトーシスは、体の臓器や組織で鉄の貯蔵が増加する代謝性疾患です。
ヘモクロマトーシスは遺伝性疾患の大きなグループに属し、腸からの鉄の吸収を調節する原因となる、いわゆるHFE遺伝子の遺伝的欠陥に基づいています。
これらの鉄の沈着物は臓器や組織を損傷し、皮膚に蓄積し、青銅色の変色を引き起こす可能性があります。影響を受ける臓器は主に心臓と肝臓です。
ヘモクロマトーシスが検出されないままである場合、肝硬変が発症し、最終的に肝細胞癌になる可能性があります。
治療法には、流血や食事による鉄分の制限が含まれます。
流血は、体内の鉄の量を減らすために診断上重要なフェリチン値を下げます。ヘモクロマトーシスの予後は、付随する疾患に依存し、本質的に肝障害の程度に依存します。
ヘモクロマトーシス患者の約35%が肝硬変により肝癌を発症します。
編集チームからの推薦
- ヘモクロマトーシスの症状
- 肝硬変-あなたはそれを知っているべきです
- 糖尿病性神経障害に関するすべて
- フェリチンレベルが高すぎる
- 遺伝子検査